Anvisa recebe primeiro pedido de uso emergencial de vacina contra a Covid-19
O pedido foi enviado pelo Instituto Butantan, que no Brasil conduz os estudos da vacina desenvolvida pela empresa Sinovac. Meta é fazer a análise do uso emergencial em até 10 dias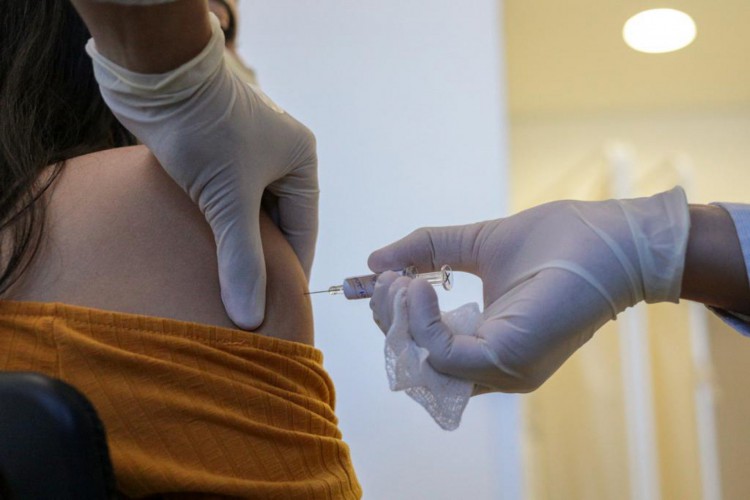
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu nesta sexta-feira, 8, o pedido de autorização temporária de uso emergencial, em caráter experimental da vacina Coronavac. O pedido foi enviado pelo Instituto Butantan, que no Brasil conduz os estudos da vacina desenvolvida pela empresa Sinovac.
O órgão afirma que já iniciou a triagem dos documentos presentes na solicitação e da proposta de uso emergencial que o laboratório pretende fazer. Ainda segundo a Agência, a meta é fazer a análise do uso emergencial em até 10 dias, descontando eventual tempo que o processo possa ficar pendente de informações, a serem apresentadas pelo laboratório.
É + que streaming. É arte, cultura e história.
"As primeiras 24h serão utilizadas para fazer uma triagem do processo e checar se os documentos necessários estão disponíveis", explica em nota.
78% de eficácia
A análise do pedido de uso emergencial é feita por uma equipe multidisciplinar, envolve especialista das áreas de registro, monitoramento e inspeção. Na quinta-feira, 7, o Butantan e o Governo de São Paulo divulgaram os dados sobre a eficácia da Coronavac: 78% em casos leves da doença e 100% contra casos graves.
LEIA MAIS | Vídeo mostra emoção da equipe do Butantan ao saber dos resultados da vacina
Entretanto, os dados apresentados não seguiram os mesmos protocolos das demais vacinas já existentes contra a Covid-19. Foram demonstrados apenas os desfechos secundários e não os primários, como os demais imunizantes anunciaram.
O dado primário da eficácia de uma vacina é calculado levando em consideração o número de eventos (pessoas que ficaram doentes, independentemente de ser leve, moderado ou grave) dentro do total de voluntários que foram vacinados com a dose do imunizante, sem contar aqueles que receberam placebo.
LEIA TAMBÉM | Associação de clínicas particulares negocia vacina contra Covid-19; três empresas são do Ceará
Uso emergencial
Em meados de dezembro, a Diretoria Colegiada da Anvisa aprovou as regras para a autorização temporária de uso emergencial, em caráter experimental, de vacinas contra a Covid-19. Entenda os principais pontos:
- Cada pedido deve ser feito pela empresa desenvolvedora e será analisado de forma independente;
- Decisão será tomada pela Diretoria Colegiada da Anvisa;
- Serão considerados estudos não-clínicos e clínicos (em humanos);
- Serão itens avaliados: qualidade, boas práticas de fabricação, estratégias de monitoramento e controle, e resultados provisórios de ensaios clínicos;
- Empresa interessada deverá comprovar que a fabricação e a estabilidade do produto garantem a qualidade da vacina;
- Estudo clínico na fase 3 – última etapa de testes – deve estar em andamento e conduzido também no Brasil;
- Vacina com uso emergencial liberado não pode ser comercializada, ela só pode ser distribuída no sistema público de saúde;
- Liberação de uso emergencial pode ser revogada pela Anvisa a qualquer momento.
LEIA TAMBÉM | Veja a situação das vacinas da Covid-19 em teste pela Anvisa
A concessão estabelecida pela Anvisa segue o modelo de autorizações emergenciais adotadas em outros países, como Reino Unido, Estados Unidos e Canadá, e vale apenas para o período de pandemia e até a vacina receber o registro definitivo.
Mais informações em instantes
Dúvidas, Críticas e Sugestões? Fale com a gente
